醫(yī)療制藥凈化工程
1,、主要控制有生命微粒(細(xì)菌)與無生命微粒(塵埃)對工作對象的污染。其內(nèi)部材料要
能經(jīng)受各種滅菌劑侵蝕,且一般保證正壓,。實質(zhì)上就是其內(nèi)部材料要能經(jīng)受各種滅菌處理的
工業(yè)潔凈室,。
2、其規(guī)劃及建造必須滿足GMP對藥品,、食品,、化妝品生產(chǎn)、包裝,、貯存衛(wèi)生的強(qiáng)制性要
求,。從硬件上保證降低藥品、食品,、化妝品生產(chǎn)過程中人為的錯誤;防止藥品,、食品,、化妝
品在生產(chǎn)過程中遭到污染或品質(zhì)劣變;建立健全產(chǎn)品質(zhì)保證體系,。
例如:制藥工業(yè)、醫(yī)院(手術(shù)室,、無菌病房)食品,、化妝品、飲料產(chǎn)品生產(chǎn),、血站等,。
—— 生物醫(yī)藥GMP車間 ——
項目概況
工程名稱:生物醫(yī)藥GMP車間
凈化等級:D級(十萬級)
空調(diào)部分:水冷式空調(diào)凈化機(jī)組、送風(fēng)管,、回風(fēng)管,、排風(fēng)管、新風(fēng)
工程內(nèi)容:內(nèi)裝,、地面,、暖通、排風(fēng),、回風(fēng),、新風(fēng)、動力電,、照明,、凈化燈、紫外燈,、弱電,、工藝管道等
其他部分:給水、純凈水、潔凈室風(fēng)淋室,、不銹鋼傳遞窗,、組合式凈化空調(diào)箱、排風(fēng)機(jī)
潔凈室系統(tǒng)設(shè)計規(guī)范
1,、國際標(biāo)準(zhǔn)《ISO/DIS 14644》
2,、潔凈室廠房設(shè)計規(guī)范《GB50073-2001》
3、醫(yī)療器械包裝車間潔凈室廠房規(guī)范《GMP-97》
4,、藥品生產(chǎn)質(zhì)量管理規(guī)范《GMP-98》
5,、潔凈室施工及難收規(guī)范《JGJ 71-90》
6、通風(fēng)與空調(diào)工程施工及驗收規(guī)范《GB 50243-2002》
7,、美國聯(lián)邦標(biāo)準(zhǔn)《FS209E-92》
潔凈室(區(qū))溫濕度要
萬級潔凈室(區(qū))溫度應(yīng)為20℃~24℃,相對濕度應(yīng)為45%~65%,;
十萬級潔凈室(區(qū))溫度應(yīng)為18℃~26℃,相對濕度應(yīng)為45%~65%,;
人員凈化用室的溫度,,冬季應(yīng)為16℃~20℃,夏季應(yīng)為26℃~30℃,。
無菌檢測實驗室要求
醫(yī)療器械GMP潔凈車間必須配備獨立凈化空調(diào)系統(tǒng)的無菌檢測室(與生產(chǎn)區(qū)分開),,要求為萬級條件下的局部百級。無菌檢測室應(yīng)包括:人員凈化室(存外衣室,、盥洗室,、穿潔凈工作服室及緩沖室)、物料凈化室(緩沖室或雙層傳遞窗),、無菌檢查間,、陽性對照間。
GB50457-2008《醫(yī)藥工業(yè)潔凈廠房設(shè)計規(guī)范》
藥品生產(chǎn)質(zhì)量管理規(guī)范(2010 年修訂)
藥品生產(chǎn)質(zhì)量管理規(guī)范(2010 年修訂)(衛(wèi)生部令第 79 號)附錄I
服務(wù)領(lǐng)域:生物制品(口服制劑,、免疫試劑,、創(chuàng)傷用品),藥品生產(chǎn)(針劑,、片劑,、膠囊、外用藥品,、中藥)等,。
重點注意事項:
1、人員凈化
1-1,、人員凈化:生物醫(yī)藥潔凈室(區(qū))的人員凈化程序宜按下圖布置
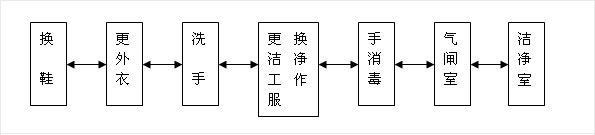
1-2,、醫(yī)藥潔凈區(qū)域的入口應(yīng)設(shè)置氣閘室;氣閘室的出入門應(yīng)設(shè)置互鎖裝置,。
1-3,、空氣潔凈等級相同的無菌潔凈室和非無菌潔凈其人員凈化用室應(yīng)分別設(shè)置。
2、物料凈化
2-1,、醫(yī)藥潔凈室的原輔物料,、包材出入口,應(yīng)設(shè)置物料凈化用室,。
2-2,、進(jìn)入無菌潔凈室的原輔料、包材除滿足以上要求外,,尚應(yīng)在出入口設(shè)置物料滅菌室和滅菌設(shè)施,。
2-3、物料清潔室或滅菌室與醫(yī)藥潔凈室之間,,應(yīng)設(shè)置氣閘室或傳遞柜,。
2-4、10萬級及以上區(qū)域工作服應(yīng)在潔凈室內(nèi)洗滌,、干燥,、整體,必要時應(yīng)按要求滅菌,。
3,、醫(yī)藥潔凈室空氣潔凈等級
醫(yī)藥潔凈室(區(qū))空氣潔凈度等級
潔凈度級別 | 懸浮粒子最大允許數(shù)立方米 |
靜態(tài) | 動態(tài) |
≥0.5μm | ≥5.0μm | ≥0.5μm | ≥5.0μm |
A級 | 3520 | 20 | 3520 | 20 |
B級 | 3520 | 29 | 352000 | 2900 |
C級 | 352000 | 2900 | 3520000 | 29000 |
D級 | 3520000 | 29000 | 不作規(guī)定 | 不作規(guī)定 |









 規(guī)劃咨詢
規(guī)劃咨詢